| |
อินดิเคเตอร์สำหรับกรด-เบส

ที่มา : http://wisor116.exteen.com/20070221/indicator
อินดิเคเตอร์ คือ สารที่ใช้บอกความเป็นกรด-เบส ของสารละลายได้อย่างหนึ่ง สารประกอบที่เปลี่ยนสีได้ที่ pH เฉพาะตัวจะถูกนำมาใช้เป็นอินดิเคเตอร์ได้ เช่น ฟีนอล์ฟทาลีน จะไม่มีสีเมื่ออยู่ในสารละลายกรด และจะเปลี่ยนเป็นสีชมพู เมื่ออยู่ในสารละลายเบสที่มี pH 8.3
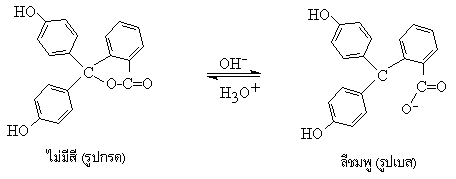
ภาพฟีนอล์ฟทาลีน
อินดิเคเตอร์สำหรับกรด-เบส เป็นสารอินทรีย์ อาจเป็นกรดหรือเบสอ่อนๆ ซึ่งสามารถเปลี่ยนจากรูปหนึ่งไปเป็นอีกรูปหนึ่งได้ เมื่อ pH ของสารละลายเปลี่ยน
การเปลี่ยนสีของอินดิเคเตอร์
HIn เป็นสัญลักษณ์ของอินดิเคเตอร์ที่อยู่ในรูปกรด (Acid form)
In- เป็นสัญลักษณ์ของอินดิเคเตอร์ที่อยู่ในรูปเบส (Basic form)
รูปกรดและรูปเบสมีภาวะสมดุล เขียนแสดงได้ด้วยสมการ ดังนี้
HIn (aq) + H2O (l) 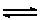 H3O+ (aq) + In- (aq) H3O+ (aq) + In- (aq)
ไม่มีสี * (รูปกรด) สีชมพู* (รูปเบส) ; (* = กรณีเป็นฟีนอล์ฟทาลีน)
Kind = 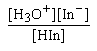
HIn และ In- มีสีต่างกันและปริมาณต่างกัน จึงทำให้สีของสารละลายเปลี่ยนแปลงได้ ถ้าปริมาณ HIn มากก็จะมีสีของรูปกรด ถ้ามีปริมาณ In- มากก็จะมีสีของรูปเบส การที่จะมีปริมาณ HIn หรือ In- มากกว่าหรือน้อยกว่านั้นขึ้นอยู่กับปริมาณ H3O+ ในสารละลาย ถ้ามี H3O+ มากก็จะรวมกับ In- ได้เป็น HIn ได้มาก แต่ถ้าอยู่ในสารละลายที่มี OH- มาก OH- จะทำปฏิกิริยากับ H3O+ ทำให้ H3O+ ลดลง ซึ่งจะมีผลทำให้เกิดปฏิกิริยาไปข้างหน้าได้ In- มากขึ้น
ช่วง pH ที่อินดิเคเตอร์เปลี่ยนสีจากรูปหนึ่งไปเป็นอีกรูปหนึ่ง สารละลายจะมีสีผสมระหว่างรูปกรดและรูปเบส เรียกว่า ช่วง pH ของอินดิเคเตอร์ (pH range หรือ pH interval)
ช่วง pH ของอินดิเคเตอร์หาได้จากค่า Kind ของอินดิเคเตอร์ดังนี้
HIn
(aq) + H2O (l) 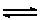 H3O+ (aq) + In- (aq) H3O+ (aq) + In- (aq)
ไม่มีสี * (รูปกรด) สีชมพู* (รูปเบส) ; (* = กรณีเป็นฟีนอล์ฟทาลีน)
Kind = 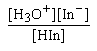
[H3O+]
= Kind - 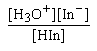
-log
[H3O+] = -logKind - 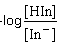
pH
= pKind- 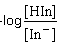
- จะเริ่มเห็นสีของรูปกรดเมื่อ 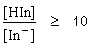
pH = pKind - log10
pH = pKind- 1
- จะเริ่มเห็นสีของรูปเบสเมื่อ 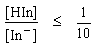
pH = pKind - log
pH = pKind+ 1
นั่นคือ ช่วง pH ของอินดิเคเตอร์ = pKind 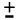 1 หมายความว่า สีของอินดิเคเตอร์จะเริ่มเปลี่ยนแปลงเมื่อ pH = pKind 1 หมายความว่า สีของอินดิเคเตอร์จะเริ่มเปลี่ยนแปลงเมื่อ pH = pKind 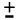 1 ซึ่งเป็นค่าโดยประมาณ แต่ถ้า [HIn] มากกว่าหรือน้อยกว่า [In- ] 10 เท่าขึ้นไป อาจถึง 100 เท่า ช่วง pH ของอินดิเคเตอร์ก็จะเปลี่ยนไป ช่วง pH ของอินดิเคเตอร์ที่ถูกต้องจริงๆ ของแต่ละอินดิเคเตอร์หาได้จากการทดลอง 1 ซึ่งเป็นค่าโดยประมาณ แต่ถ้า [HIn] มากกว่าหรือน้อยกว่า [In- ] 10 เท่าขึ้นไป อาจถึง 100 เท่า ช่วง pH ของอินดิเคเตอร์ก็จะเปลี่ยนไป ช่วง pH ของอินดิเคเตอร์ที่ถูกต้องจริงๆ ของแต่ละอินดิเคเตอร์หาได้จากการทดลอง
ตัวอย่างเช่น เมทิลเรด มีช่วง pH 4.4 - 6.2 หมายความว่า สารละลายที่หยดเมทิลเรดลงไป จะเปลี่ยนสีจากรูปกรด (แดง) ไปเป็นรูปเบส (เหลือง) ในช่วง pH ตั้งแต่ 4.4 - 6.2 นั่นคือ
- ถ้า pH < 4.4 จะให้สีแดง (รูปกรด)
- pH อยู่ระหว่าง 4.4 - 6.2 จะให้สีผสมระหว่างสีแดงกับเหลือง คือ สีส้ม
- pH > 6.2 จะให้สีเหลือง (รูปเบส)
สีของอินดิเคเตอร์แต่ละชนิด จะเปลี่ยนในช่วง pH ที่ต่างกัน ซึ่งแสดงได้ดังภาพ
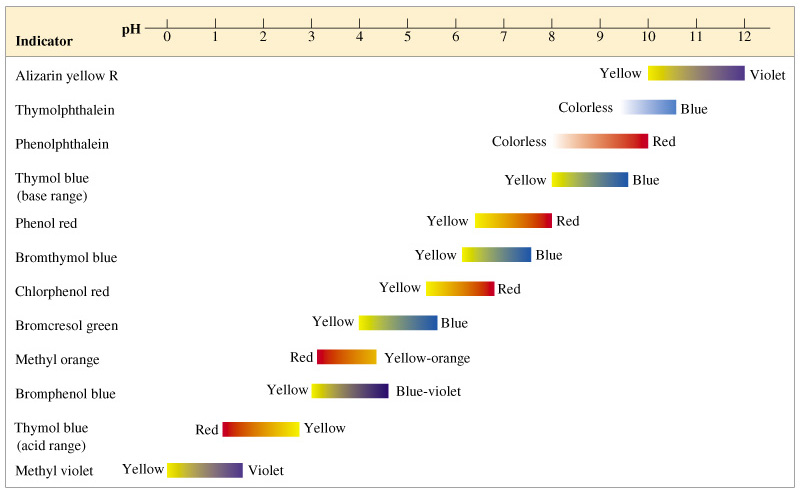
ภาพแสดงสีของอินดิเคเตอร์แต่ละชนิด
ที่มา : http://majorchemspa.wordpress.com/ab_8/
อย่างไรก็ตาม อินดิเคเตอร์ชนิดหนึ่งๆ จะใช้หาค่า pH ของสารละลายได้อย่างคร่าวๆ เท่านั้น เช่น เมื่อนำสารละลายมาเติม เมทิลออเรนจ์ลงไป (ช่วง pH ของเมทิลออเรนจ์เท่ากับ 3.0 - 4.4 และสีที่เปลี่ยนอยู่ในช่วง สีแดง  เหลือง) เหลือง)
ถ้าสารละลายมีสีเหลืองหลังจากหยดเมทิลออเรนจ์ แสดงว่าสารละลายนี้มี pH ตั้งแต่ 4.4 ขึ้นไป ซึ่งอาจมีฤทธิ์เป็นกรด กลางหรือ เบส ก็ได้ ดังนั้น การหาค่า pH ของสารละลายหนึ่งๆ อาจจะต้องใช้อินดิเคเตอร์หลายๆ ตัว แล้วนำข้อมูลมาวิเคราะห์ pH ของสารละลายร่วมกัน
ตัวอย่าง การทดลองหาค่า pH ของสารละลายชนิดหนึ่ง โดยใช้อินดิเคเตอร์ 5 ชนิดด้วยกัน ผลการทดลองเป็นดังนี้
| ชนิดของอินดิเคเตอร์ |
ช่วง
pH |
สีที่เปลี่ยน |
สีสารละลายที่ได้จากการทดลอง |
| 1. methyl yellow |
2.9-4.0 |
สีแดง-เหลือง |
เหลือง |
| 2. Bromeresol green |
3.8-5.4 |
เหลือง-น้ำเงิน |
น้ำเงิน |
| 3. Methyl red |
4.4-6.2 |
แดง-เหลือง |
ส้ม |
| 4. Bromothymol blue |
6.0-7.6 |
เหลือง-น้ำเงิน |
เหลือง |
| 5. Phenophtalein |
8.0-9.6 |
ไม่มีสี-สีชมพู |
ไม่มีสี |
ให้หาค่า pH ของสารละลายจากข้อมูลการทดลองข้างต้น
แนวคิด จากอินดิเคเตอร์ชนิดที่ 1 แสดงว่า pH ของสารละลาย > 4 จากอินดิเคเตอร์ชนิดที่ 2 แสดงว่า pH ของสารละลายอยู่ระหว่าง 4.4-6.2 จากอินดิเคเตอร์ชนิดที่ 3 แสดงว่า pH ของสารละลาย > 5.4 จากอินดิเคเตอร์ชนิดที่ 4 แสดงว่า pH ของสารละลาย < 6 จากอินดิเคเตอร์ชนิดที่ 5 แสดงว่า pH ของสารละลาย < 8.0 สรุปได้ว่า สารละลายมี pH อยู่ระหว่าง 5.4 - 6
การหา pH ของสารละลายโดยใช้อินดิเคเตอร์หลายๆ ชนิดนี้ ไม่สะดวกในการใช้ จึงมีการคิดที่จะนำอินดิเคเตอร์หลายๆ ชนิด ซึ่งเปลี่ยนสีในช่วง pH ต่างๆ กันมาผสมกันในสัดส่วนที่เหมาะสม จะสามารถใช้บอกค่า pH ของสารละลายได้ละเอียดขึ้น อินดิเคเตอร์ผสมนี้เรียกว่า ยูนิเวอร์ซัลอินดิเคเตอร์ ซึ่งสามารถเปลี่ยนสีได้ในสารละลายที่มี pH ต่างๆ กันเกือบทุกค่า
การใช้ยูนิเวอร์ซัลอินดิเคเตอร์ หยดยูนิเวอร์ซัลอินดิเคเตอร์ลงในสารละลายที่ต้องการหาค่า pH ประมาณ 3 หยดต่อสารละลาย 3 cm3 สังเกตสีของสารละลายแล้วเปรียบเทียบกับสีมาตรฐานของยูนิเวอร์ซัลอินดิเคเตอร์ที่ pH ต่างๆ ว่าสีของสารละลายตรงกับสีมาตรฐานที่ pH ใด ก็จะมีค่าเท่ากับ pH นั้น
ตาราง การเปลี่ยนสีของสารละลาย เมื่อใช้ยูนิเวอร์ซัลอินดิเคเตอร์
| pH สารละลาย |
สี |
| 3 |
แดง |
| 4 |
ส้มแดง |
| 5 |
ส้ม |
| 6 |
ส้มเหลือง |
| 7 |
เหลืองเขียว |
| 8 |
เขียว |
| 9 |
น้ำเงินเขียว |
| 10 |
ม่วง |
| 11 |
ม่วงแดง |
 แบบฝึกหัด แบบฝึกหัด
หน่วยที่ 3 : เรื่อง pH ของสารละลายและอินดิเคเตอร์
สำหรับกรด - เบส
|