| |
คู่กรด - เบส
จากปฏิกิริยาของกรดกับเบสที่กล่าวถึงแล้ว ตามทฤษฎีของเบรินสเตต- เลาว์รี จะเห็นว่าในปฏิกิริยาหนึ่งๆ อาจจะจัดคู่กรด- เบสได้ 2 คู่ด้วยกัน ตัวอย่างเช่น
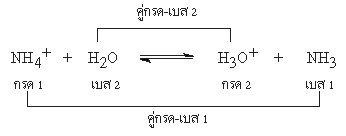
ปฏิกิริยาตัวอย่างนี้ ปฏิกิริยาไปข้างหน้า NH4+ ทำหน้าที่เป็นกรด เพราะให้ H+ กับ H2O แล้วได้เป็น NH3และ H2O รับ
H+ ทำหน้าที่เป็นเบส ส่วนปฏิกิริยาย้อนกลับ H3O+ เป็นกรด เพราะให้ H+ กับ NH3 ซึ่งเป็นเบส แล้วได้ H2O และ NH4+ ตามลำดับ
เรียก NH4+ ว่าคู่กรดของ NH3 ( เบส)
H2O ว่าคู่เบสของ H3O+ ( กรด)
NH3 ว่าคู่เบสของ NH4+
H3O+ ว่าคู่กรดของ H2O
จะเห็นได้ว่า คู่กรด- เบสนั้นจะมีจำนวนโปรตอน (H) ต่างกัน 1 ตัว หรืออาจกล่าวได้ว่า จำนวนโปรตอนของคู่กรด จะมากกว่าโปรตอนคู่เบสอยู่ 1 ตัวเสมอ
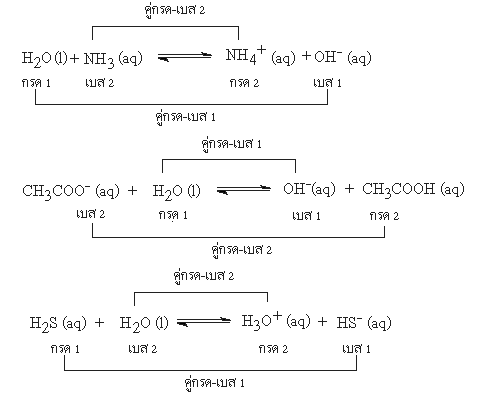
ตัวอย่างอื่นๆ ของปฏิกิริยาคู่กรด - เบส
ความแรงของกรดและเบส
การเปรียบเทียบความแรงของกรดและเบส อาจจะพิจารณาได้ดังนี้
1. ดูจากการแตกตัวของกรด
กรดที่มีการแตกตัวมาก มีความเป็นกรดมาก กรดและเบสที่แตกตัวได้ 100% จะเรียกว่ากรดแก่ และเบสแก่ ตามลำดับ ซึ่งสามารถนำไฟฟ้าได้ดี แต่ถ้ากรดและเบสนั้นแตกตัวได้เพียงบางส่วนก็จะเรียกว่า กรดอ่อน หรือเบสอ่อน ตามลำดับ ซึ่งการนำไฟฟ้าจะไม่ดี
สำหรับการพิจารณาค่าการแตกตัวของกรดและเบสนั้น นอกจากจะคิดจากเปอร์เซ็นต์การแตกตัว หรืออาจจะดูได้จากค่าคงที่สมดุลของการแตกตัวของกรดหรือเบส (Ka หรือ Kb) เช่น
ความแรงของเบส พิจารณาจากค่า Kb กล่าวคือ ถ้ามีค่า Kb มาก มีความเป็นเบสมากกว่า Kb น้อย เช่น
NH3 Kb = 1.76 x 10-5
N2H4 Kb = 9.5 x 10-7
C 6H5NH2 Kb = 4.3
x 10 -10
ความเป็นเบส NH3> N2H4 > C6H5NH2
ที่มา : http://wisor116.exteen.com/20070221/indicator
2. ดูจากความสามารถในการให้และรับโปรตอน
กรดแก่ ได้แก่ กรดที่ให้โปรตอนได้มาก
กรดอ่อน ได้แก่ กรดที่ให้โปรตอนได้น้อย
เบสแก่ ได้แก่ เบสที่รับโปรตอนได้มาก
เบสอ่อน ได้แก่ เบสที่รับโปรตอนได้น้อย
โดยมีข้อสังเกตเกี่ยวกับคู่กรด- เบส ดังนี้
- ถ้ากรดเป็นกรดแก่ คู่เบสจะเป็นเบสอ่อน เช่น
HCl (aq) + H2O(l) 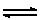 H3O+ (aq)
+ Cl- (aq) H3O+ (aq)
+ Cl- (aq)
กรดแก่ เบสอ่อน
- ถ้ากรดเป็นกรดอ่อน คู่เบสจะเป็นเบสแก่ เช่น
HS- (aq) + H2O(l)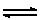 H3O+(aq) + S2- (aq) H3O+(aq) + S2- (aq)
กรดอ่อน เบสแก่
- ถ้าเบสเป็นเบสแก่ คู่กรดจะเป็น กรดอ่อน เช่น
H3O+(aq) + S2-(aq) 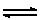 HS- (aq) + H2O(l) HS- (aq) + H2O(l)
เบสแก่ กรดอ่อน
- ถ้าเบสเป็นเบสอ่อน คู่กรดจะเป็น กรดแก่ เช่น
Cl-(aq) + H3O+(aq) 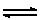 HCl(aq) + H2O(l) HCl(aq) + H2O(l)
เบสอ่อน กรดแก่
ตารางลำดับความแรงของกรดและเบสตัวอย่างตามทฤษฎีของเบรินสเตต- เลาว์รี
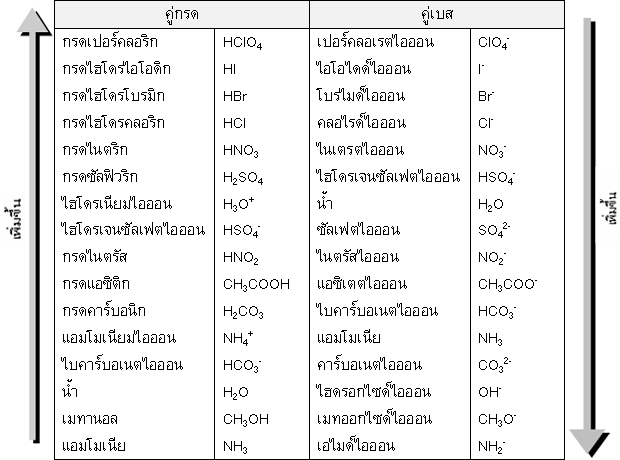
3. ดูจากการเรียงลำดับในตารางธาตุ
การพิจารณาความแรงของกรดและเบสดูจากการเรียงลำดับของธาตุที่อยู่ในกรดนั้น ตามตารางธาตุ ซึ่งแบ่งออกได้เป็น
3.1 กรดออกซี หมายถึง กรดที่ประกอบด้วย H, O และธาตุอื่นอีก เช่น HNO3 ,H3PO4,H3AsO4 ,HClO4 ถ้าจำนวนอะตอมออกซิเจนเท่ากัน ความแรงของกรดเรียงลำดับดังนี้
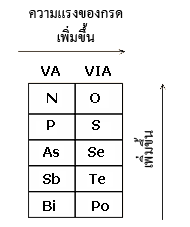
ดังนั้น H2SO4 > H2SeO4 , H3PO4 > H3AsO4
3.2 กรดที่ไม่มีออกซิเจน เช่น HCl, HBr, HF, และ HI ความแรงของกรดแรงลำดับดังนี้
HI > HBr > HCl > HF
H2S > H2O
 แบบฝึกหัด แบบฝึกหัด
หน่วยที่ 1 : เรื่องสารละลายอิเล็กทรอไลต์นอนอิเล็กทรอไลต์
สารละลายกรด ทฤษฏีกรด-เบส และคู่กรด-เบส
|