| |
การแตกตัวของน้ำบริสุทธิ์

ที่มา : http://www.zuxzix.com/article/article_print.php?artID=384&artPage=1
น้ำเป็นอิเล็กทรอไลต์ที่อ่อนมาก แตกตัวได้น้อยมาก ดังนั้น การนำไฟฟ้าของน้ำจะน้อย จนไม่สามารถตรวจสอบได้ด้วยการนำไฟฟ้าผ่านหลอดไฟ แต่ตรวจได้ด้วยเครื่องวัดกระแส (แอมมิเตอร์)
ตัวอย่างการวัดการนำไฟฟ้าของน้ำชนิดต่างๆ ได้แก่ น้ำกลั่นที่อุณหภูมิห้อง น้ำกลั่นที่อุณหภูมิ 60 - 70 องศาเซลเซียส น้ำคลอง น้ำประปา และน้ำฝน จะได้ผลดังตาราง
ตารางตัวอย่างการนำไฟฟ้าของน้ำชนิดต่างๆ
| น้ำชนิดต่าง ๆ |
เครื่องตรวจการนำไฟฟ้า |
วัดด้วยแอมมิเตอร์ |
| น้ำกลั่นที่อุณหภูมิห้อง |
หลอดไฟไม่สว่าง |
40 |
| น้ำกลั่นที่อุณหภูมิ 60-70 oC |
หลอดไฟไม่สว่าง |
80 |
| น้ำคลอง |
หลอดไฟไม่สว่าง |
90 |
| น้ำประปา |
หลอดไฟไม่สว่าง |
85 |
| น้ำฝน |
หลอดไฟไม่สว่าง |
80 |
ตามทฤษฎีของเบรินสเตตและเลาว์รี น้ำทำหน้าที่เป็นทั้งกรดและเบส ไอออนที่เกิดขึ้นจากการแตกตัวของน้ำ และมีการถ่ายเทโปรตอนกันเองได้ ( ออโตไอออนไนเซชัน)
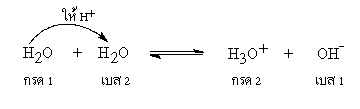
โมเลกุลของน้ำที่เสีย H+ จะเปลี่ยนเป็น OH- ซึ่งมีประจุลบและโมเลกุลของน้ำที่ได้รับ H+ จะเปลี่ยนเป็น H3O+ ซึ่งมีประจุบวก เราอาจเขียนสมการกรด- เบส ได้ง่ายๆ ดังนี้
H2O (l) + H2O (l) 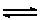 H3O+ (aq) + OH-(aq) H3O+ (aq) + OH-(aq)
เนื่องจากระบบนี้อยู่ในภาวะสมดุล สามารถเขียนสมการค่าคงที่สมดุลของ H2O ได้ดังนี้
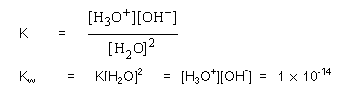
Kw คือค่าคงที่การแตกตัวของน้ำ มีค่าเท่ากับ 1 x 10-14 ที่ 25oC เนื่องจากน้ำบริสุทธิ์แตกตัวเป็นไอออนจะให้ความเข้มข้นของ H3O+ และ OH- เท่ากัน
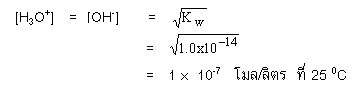
ดังนั้น น้ำบริสุทธิ์จึงมีสภาพเป็นกลางเนื่องจากปริมาณ H3O+ เท่ากับ
OH- ค่าคงที่สมดุลของน้ำมีค่าเปลี่ยนแปลงตามอุณหภูมิ แสดงดังตารางต่อไปนี้
ตารางค่า Kw ของน้ำที่อุณหภูมิต่างๆ
| อุณหภูมิ(0C) |
Kw |
| 0 |
0.114 x 10-14 |
| 10 |
0.296 x 10-14 |
| 20 |
0.681 x 10-14 |
| 25 |
1.010 x 10-14 |
| 30 |
1.470 x 10-14 |
| 40 |
2.920 x 10-14 |
| 50 |
5.470 x 10-14 |
| 60 |
9.610 x 10-14 |
 แบบฝึกหัด แบบฝึกหัด
หน่วยที่ 2 : เรื่องการแตกตัวของกรด เบส และน้ำ
|