| |
สารละลายบัฟเฟอร์
สารละลายบัฟเฟอร์ (buffer solution) หมายถึงสารละลายของกรดอ่อนกับเกลือของกรดอ่อน หรือคู่เบสของกรดอ่อน หรือหมายถึงสารละลายของเบสอ่อนกับเกลือของเบสอ่อน
หรือคู่กรดของเบสอ่อนนั้น สมบัติของสารละลายบัฟเฟอร์ คือ รักษาสภาพ pH ของสารละลายเอาไว้โดยจะเกิดการเปลี่ยนแปลงน้อยมากเมื่อเติมกรดแก่หรือเบสแก่จำนวนเล็กน้อยลงไป การเตรียมทำได้โดยการเติมกรดอ่อนลงในสารละลายเกลือของกรดอ่อน หรือการเติมเบสอ่อนลงในสารละลายเกลือของเบสอ่อน
ตัวอย่างสารละลายบัฟเฟอร์ เช่น
1.บัฟเฟอร์ของกรดอ่อนกับคู่เบสของกรดอ่อน(เกลือ)
เช่น CH3COOH/CH3COONa มี pH <7
2.บัฟเฟอร์ของเบสอ่อนกับคู่กรดของเบสอ่อน(เกลือ)
เช่น NH3OH/NH4Cl มี pH >7
การคำนวณเกี่ยวกับบัฟเฟอร์
1. pH = Pka + log [salt]/[Acid]
2. pOH=Pkb +log[salt]/[Base]
ตัวอย่าง
1. จงคำนวณหา pH ของสารละลาย 1.00M CH3COONa(Ka ของ CH3COOH=1.8x10-5 ที่ 25 o C)
วิธีทำ
CH3COONa(s) 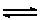 CH3COO - (aq) + Na +(aq) CH3COO - (aq) + Na +(aq)
CH3COOH(aq)
+ H2O(l) 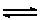 CH3COO-(aq)+H3O+(aq) CH3COO-(aq)+H3O+(aq)
ความเข้มข้นเริ่มต้น 1.00 M 1.00 M
ขณะเปลี่ยนแปลง -x +x +x
ที่สมดุล 1.00 M -x 1.00 M +x +x
Ka
=[ CH3COO - ][ H3O+]/[
CH3COOH ]
1.8x10-5 = x(1.00)/1.00
x
= [ H3O+] =1.8x10-5
pH
=-log[ H3O+]
=-log(1.8x10-5)
= 4.74
2. เมื่อเติม 0.02M OH- ลงในสารละลาย ในข้อ 1 pH จะเป็นเท่าใด
วิธีทำ
CH3COOH(aq)
+ OH-(aq) 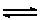 CH3COO-(aq) + H2O(l) CH3COO-(aq) + H2O(l)
เมื่อเริ่มต้น 1.00 M 1.00 M
เติมเบส 0.02M
ขณะเปลี่ยนแปลง -0.02 M -0.02M +0.02M
หลังจากปฏิกิริยา 0.98M 0M 1.02M
pH = Pka+ log [CH3COO - ]/[ CH3COOH
]
=-log(1.8x10-5)
+log(1.02/0.98)
= 4.77
|