| |
pH ของสารละลาย
pH คือ ค่าที่แสดงถึงความเข้มข้นของไฮโดรเจนไอออน (H+) หรือไฮโดรเนียมไอออน (H3O+) ใช้บอกความเป็นกรดหรือเบสของสารละลาย โดยค่า pH ของสารละลายเป็นค่าลอการิทึมของไฮโดรเจนไอออน (หรือไฮโดรเนียมไอออน) ที่เป็นลบ
pH
= -log [H3O+] หรือ [H3O+] = 10-pH โดยที่ [H3O+] คือ ความเข้มข้นของ H3O+ หรือ H+ เป็นโมล/ลิตร
น้ำบริสุทธิ์ ที่อุณหภูมิ 25 oC จะมี [H3O+]
= 1 x 10 -7 โมล/ลิตร
ดังนั้น pH = -log [H3O+] = -log [1 x 10 -7] = 7
นั่นคือ pH ของน้ำบริสุทธิ์ ที่อุณหภูมิ 25 oC เท่ากับ 7 ถือว่ามีสภาพเป็นกลาง คือไม่มีความเป็นกรดหรือเบส
ถ้า [H3O+] = 1 x 10 -5 ; pH = -log [H3O+] = -log
[1 x 10 -5] = 5 (เป็นกรด)
ถ้า
[H3O+] = 1 x 10 -9 ; pH = -log [H3O+] = -log
[1 x 10 -9] = 9 (เป็นเบส)
ดังนั้นสรุปว่า
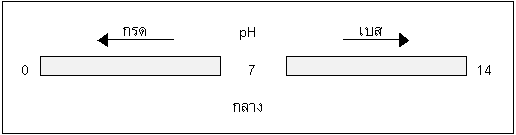
pH < 7 สารละลายเป็นกรด
pH = 7 สารละลายเป็นกลาง
pH > 7 สารละลายเป็นเบส
หรืออาจจะเขียนเป็นสเกลได้ดังนี้
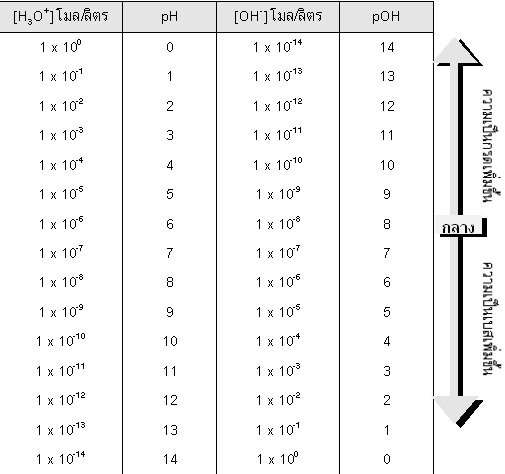
นอกจากจะบอกความเป็นกรดเป็นเบสของสารละลายด้วยค่า pH แล้วยังสามารถบอกค่าความเป็นกรด-เบส ได้โดยใช้ค่า pOH ซึ่ง ค่า pOH ของสารละลาย คือ ค่าที่บอกความเข้มข้นของ OH-
pOH = - log[OH- ]
โดย pH + pOH = 14
ตารางแสดง สเกล pH ของสารละลายที่มีความเข้มข้นต่างๆ กัน
วิธีวัด pH ของสารละลายวัดได้ 2 วิธี ดังนี้
1. วิธีเปรียบเทียบสี วิธีนี้เป็นการวัด pH โดยประมาณ (มีความถูกต้อง 0.5 หน่วย pH) ซึ่งทำได้โดยเติมอินดิเคเตอร์ที่เหมาะสมลงไปในสารละลายที่ต้องการวัด pH แล้วเปรียบเทียบกับสารละลาย ทำได้โดยเติมอินดิเคเตอร์ที่เหมาะสมลงไปในสารละลายที่ต้องการวัด pH แล้วเปรียบเทียบสีกับสารละลายบัฟเฟอร์ที่ทราบค่า pH แน่นอน ซึ่งเติมอินดิเคเตอร์ชนิดเดียวกัน หรือใช้กระดาษชุบอินดิเคเตอร์ (กระดาษ pH) จุ่มลงไปแล้วเปรียบเทียบกับสีมาตรฐาน
2. วิธีวัดความต่างศักย์ วิธีนี้วัด pH ได้อย่างละเอียด (มีความถูกต้อง 0.01 หน่วย pH) โดยการใช้เครื่องมือที่เรียกว่า พีเอชมิเตอร์ ซึ่งวัด pH ของสารละลายได้โดยการวัดความต่างศักย์ระหว่างขั้วไฟฟ้า 2 ขั้ว

ภาพแสดงเครื่องพีเอชมิเตอร์
ที่มา : http://www.il.mahidol.ac.th/e-media/acid-base
ตัวอย่างที่ 1 ให้หาค่า pH ของสารละลายที่มี H3 O+ เท่ากับ 1 x 10 -11 และ 6 x 10 -14 โมล/ลิตร
วิธีทำ
[
H3 O+] = 1 x 10-11
pH
= -log[ H3 O+] = -log[1 x 10-11 ] = 11
[
H3 O+] = 6 x 10-4
pH
= -log[ H3 O+] = -log[6 x 10-4 ] = 4 - log6 = 4 - 0.78 = 3.22
ตัวอย่างที่ 2 จงหา pH ของสารละลายที่มีความเข้มข้นของ H3O+ = 4.8 x 10-13 โมล/ลิตร
วิธีทำ
pH
= -log[ H3 O+]
=
-log[4.8 x 10-13]
=
13 - log 4.8
=
12.32
ตัวอย่างที่ 3 สารละลายชนิดหนึ่งมี pH = 4.00 จะมีความเข้มข้นของไฮโดรเนียมไอออนเป็นเท่าใด
วิธีทำ
pH
= -log[ H3 O+]
4
= -log[ H3 O+]
[
H3 O+] = 10-4
=
1 x 10-4
ตัวอย่างที่ 4 จงคำนวณหา [H+ ], [OH- ] , pH , และ pOH ของสารละลายที่มีกรดแก่ HX 0.01 โมลในน้ำ 500 cm3
วิธีทำ
กรดแก่ HX แตกตัวได้ 100 %
[HX] = 0.1 โมล/0.5 ลิตร = 0.02 โมล/ลิตร
HX
 H+ (aq) + X - (aq) H+ (aq) + X - (aq)
0.02 โมล/ลิตร 0.02 โมล/ลิตร
เพราะฉะนั้น [H+] = 0.02 โมล/ลิตร
จาก [H+][OH- ] = 1 x 10-14 โมล/ลิตร
[OH- ] = 5.0 x 10-13
เพราะฉะนั้น [OH- ] = 5.0 x 10-13 โมล/ลิตร
pH = -log[H+] = -log(0.02) = 1.70
pH + pOH = 14
pOH = 14 - pH = 14 - 1.70 = 12.30
|