| |
ปฏิกิริยาของกรด-เบส
จากทฤษฎีกรด-เบสของเบรินสเตตและเลาว์รี
กรดคือสารที่ให้โปรตอน และเบสคือ สารที่รับโปรตอน เมื่อกรดทำปฏิกิริยากับเบส
จึงมีการถ่ายโอนโปรตอนระหว่างกรดและเบสนั่นเอง ตัวอย่างเช่น ปฏิกิริยาระหว่าง
HCl และ NaOH สามารถเขียนปฏิกิริยาได้ดังนี้
HCl (aq) + NaOH (aq)  NaCl (aq) + H2O NaCl (aq) + H2O
HCl
เป็นกรดจะให้โปรตอน (H+) กับเบส NaOH ได้เกลือ NaCl กับน้ำ
โปรตอนถ่ายโอนจากกรด HCl ไปให้กับเบส NaOH เมื่อเขียนสมการไอออนิกสุทธิระหว่างกรดและเบสจะได้ดังนี้
H+ (aq) + OH- (aq)  H2O (l) H2O (l)
ปฏิกิริยาระหว่าง
H+ จากสารละลายกรดกับ OH- จากสารละลายเบสได้
H2O เรียกว่า ปฏิกิริยาสะเทิน (Neutralization reaction)
ปฏิกิริยาระหว่างกรดกับเบส จะได้เกลือกับน้ำเป็นส่วนใหญ่ แต่จะมีบางปฏิกิริยาที่ได้เกลือเพียงอย่างเดียว
เช่น ปฏิกิริยาระหว่าง HCl กับ NH3 ได้เกลือ NH4Cl
ซึ่งเกลือ NH4Cl จะแตกตัวให้ NH4+ และ Cl- ทำให้สารละลายนำไฟฟ้าได้
HCl (aq) + NH3  NH4Cl (aq) NH4Cl (aq)  NH4+ (aq) + Cl-(aq) NH4+ (aq) + Cl-(aq)
ตัวอย่างปฏิกิริยาระหว่างกรดซัลฟิวริกกับแบเรียมไฮดรอกไซด์จะได้ตะกอน
BaSO4 กับน้ำ
H2SO4 (aq) + Ba(OH)2 (aq)  BaSO4 (s) + 2H2O (l) BaSO4 (s) + 2H2O (l)
สารละลาย
H2SO4 และสารละลาย BaSO4 นำไฟฟ้าได้
แต่เมื่อนำมาผสมเข้าด้วยกันแล้วสารละลายที่ได้ไม่สามารถนำไฟฟ้าได้เพราะ
BaSO4 เป็นของแข็งที่ละลายน้ำได้น้อยมาก จึงไม่มีไอออนที่จะนำไฟฟ้าได้

ที่มา : http://www.elmhurst.edu/~chm/vchembook/182bases.html
ปฏิกิริยาระหว่างกรดกับเบส สามารถแบ่งได้ดังนี้
1.ปฏิกิริยาระหว่างกรดแก่กับเบสแก่
เช่น ปฏิกิริยาระหว่างกรดแก่ HCl กับเบสแก่ KOH ได้เกลือ KCl และน้ำ
ดังนี้
HCl (aq) + KOH (aq)  KCl (aq) + H2O (l) KCl (aq) + H2O (l)
2.ปฏิกิริยาระหว่างกรดแก่กับเบสอ่อน
เช่น ปฏิกิริยาระหว่างกรดแก่ HCl กับเบสอ่อน NH4OH ได้เกลือ
NH4Cl และน้ำ
HCl (aq) + NH4OH (aq)  NH4Cl (aq) + H2O (l) NH4Cl (aq) + H2O (l)
3.ปฏิกิริยาระหว่างกรดอ่อนกับเบสแก่
เช่น ปฏิกิริยาระหว่างกรด CH3COOH และเบส NaOH ได้เกลือโซเดียมแอซิเตต
(CH3COONa) และน้ำ
CH3COOH (aq) + NaOH (aq)  CH3COONa (aq) + H2O (l) CH3COONa (aq) + H2O (l)
4.ปฏิกิริยาระหว่างกรดอ่อนกับเบสอ่อน
เช่น ปฏิกิริยาระหว่างกรด HCN กับเบส NH4OH ได้เกลือ
NH4CN และน้ำ
HCN (aq) + NH4OH (aq)  NH4CN (aq) + H2O (l) NH4CN (aq) + H2O (l)
ปฏิกิริยาระหว่างกรดและเบสในน้ำนี้จะทำให้สารละลายที่ได้แสดงสมบัติเป็นกรด
เบส หรือกลางได้ ซึ่งพิจารณาได้เป็น 2 กรณี
1.ในกรณีกรดและเบสทำปฏิกิริยากันแล้วมีกรดหรือเบสเหลืออยู่ ถ้ามีกรดเหลืออยู่สารละลายแสดงสมบัติเป็นกรด
ถ้ามีเบสเหลืออยู่สารละลายก็จะแสดงสมบัติเป็นเบส
2.ถ้ากรดกับเบสทำปฏิกิริยากันหมดพอดี ได้เกลือกับน้ำ สารละลายของเกลือที่ได้จากปฏิกิริยา
จะแสดงสมบัติเป็นกรด เบส หรือกลาง ขึ้นอยู่กับชนิดของเกลือนั้นว่ามาจากกรดและเบสประเภทใด
ทั้งนี้เพราะเกลือแต่ละชนิดจะเกิดการแตกตัวและทำปฏิกิริยากับน้ำ
เรียกว่า ไฮโดรลิซิส ซึ่งจะทำให้สารละลายแสดงสมบัติกรด-เบสต่างกัน
รายละเอียดอยู่ในหัวข้อต่อไป
ปฏิกิริยาของกรดหรือเบสกับสารบางชนิด
กรดนอกจากจะสามารถทำปฏิกิริยาสะเทินกับเบสได้เกลือกับน้ำ แล้วยังสามารถทำปฏิกิริยากับโลหะบางชนิด
เช่น Zn, Fe, ได้ก๊าซ H2 และเกลือของโลหะนั้น หรือทำปฏิกิริยากับเกลือคาร์บอเนต
เช่น CaCO3 , Na2CO3 หรือเกลือ
NaHCO3 ได้ก๊าซ CO2
ตัวอย่างปฏิกิริยาระหว่าง HCl กับ CaCO3 จะได้เกลือและก๊าซ
CO2
HCl(aq) + CaCO3 (s)  CaCl2 (aq) + CO2 (g) CaCl2 (aq) + CO2 (g)
เบสก็เช่นเดียวกันนอกจากจะทำปฏิกิริยาสะเทินกับกรดได้เกลือกับน้ำแล้ว
ยังสามารถทำปฏิกิริยากับเกลือแอมโมเนียมเช่น NH4Cl, (NH4)2SO4 , จะได้ก๊าซ NH3 หรือทำปฏิกิริยากับเกลือ เช่นปฏิกิริยาระหว่าง
NaOH กับ FeCl3 ได้สารผลิตภัณฑ์ดังนี้
3NaOH (aq) + FeCl3 (aq)  Fe(OH)2 (s) + 3NaCl (aq) Fe(OH)2 (s) + 3NaCl (aq)
ดังนั้น จะเห็นได้ว่ากรดและเบสทำปฏิกิริยากันเองได้
และทั้งกรดและเบสก็สามารถทำปฏิกิริยากับสารอื่นได้ด้วย
เกลือ (Salt)
เกลือเป็นสารประกอบไอออนิก ประกอบด้วยไอออนบวก (แคตไอออน) และไอออนลบ
(แอนไอออน) ยกเว้น OH- ตัวอย่างเช่น NaCl ประกอบด้วยโซเดียมไอออน
(Na+) และคลอไรด์ไอออน (Cl-) แบเรียมซัลเฟต
(BaSO4) ประกอบด้วยแบเรียมไอออน (Ba2+) และซัลเฟตไอออน
(SO42-) เกลือ NaCl ละลายในน้ำได้ดีและให้
Na+ และ Cl- แต่เกลือ BaSO4 เป็นเกลือที่ไม่ละลายน้ำ
ทำให้สารละลายของเกลือ NaCl นำไฟฟ้าได้ดี แต่สารละลายของเกลือ BaSO4 ไม่นำไฟฟ้า
เราอาจจำแนกเกลือออกได้เป็นประเภทต่างๆ ดังนี้
1.เกลือปกติ (Normal salt)
เกลือปกติเป็นเกลือที่ไม่มีไฮโดรเจนหรือไฮดรอกไซด์ไอออนที่อาจถูกแทนที่
ดังนั้น จึงประกอบด้วยไอออนบวกคือโลหะ หรือกลุ่มธาตุที่เทียบเท่าโลหะ
เช่น NH4+ (แอมโมเนียมไอออน) กับไอออนลบซึ่งเป็นอนุมูลกรด
(Acid radical) ตัวอย่างของเกลือปกติ เช่น NaCl K2SO4 , Ca3(PO4)2 , NH4NO3 , (NH4)2SO4 , ZnSO4 เป็นต้น
2.เกลือกรด (Acid salt)
เกลือประเภทนี้มี H อะตอมอยู่ในโมเลกุลของเกลือ ซึ่งสามารถไอออไนซ์ได้
(แตกตัวเป็นไอออนได้) เช่น NaHSO4 , NaHCO3 , Na2HPO4 , NaH2PO4 เป็นต้น
3.เกลือเบสิก (Base salt)
เกลือประเภทนี้มีไอออนลบ OH- และไอออนบวก เช่น Pb(OH)Cl,
Bi(OH)2Cl เป็นต้น
4.เกลือสองเชิง (Double salt)
เกิดจากเกลือปกติสองชนิดรวมกันเป็นโมเลกุลใหญ่ เช่น K2SO4 , Al(SO4)3.24H2O เป็นต้น
5.เกลือเชิงซ้อน (Complex salt)
ประกอบด้วยไอออนลบที่ไอออนเชิงซ้อน เช่น K3Fe(CN)6 เป็นต้น
การเรียกชื่อเกลือ
1.ให้อ่านโลหะแล้วตามด้วยอนุมูลกรด เช่น
NaCl = โซเดียมคลอไรด์
KI = โพแทศเซียมไอโอไดด์
MgS = แมกนีเซียมซัลไฟด์
ถ้าอนุมูลกรดมาจากกรดที่ลงท้ายด้วย ous ต้องเปลี่ยนเป็น ite แต่ถ้าลงท้ายด้วย
ic ต้องเปลี่ยนเป็น ate เช่น
Na2CO3 = โซเดียมคาร์บอเนต
Ca3(PO4)2 = แคลเซียมฟอสเฟต
K2SO4 = โพแทสเซียมซัลเฟต
Na2SO4 = โซเดียมซัลเฟต
2.ถ้าโลหะมีเลขออกซิเดชัน (ประจุไฟฟ้า) มากกว่า 1 ค่าให้บอกไว้ในวงเล็บหลังโลหะนั้น
แล้วอ่านตามด้วยอนุมูลกรด เช่น
Fe(NO3)2 = ไอร์ออน (II) ไนเตรต
Fe(NO3)3 = ไอร์ออน (III) ไนเตรต
SnCl2 = ทิน (II) คลอไรด์
SnCl4 = ทิน (IV) คลอไรด์
วิธีการเตรียมเกลือ
1.เตรียมจากปฏิกิริยาระหว่างกรดกับเบส
กรด + เบส  เกลือ
+ น้ำ เกลือ
+ น้ำ
เช่น HCl (aq) + NaOH (aq)  NaCl (aq) + H2O (l) NaCl (aq) + H2O (l)
H2SO4 (aq) + Ba(OH)2 (aq)  BaSO4 (s) + 2H2O (l) BaSO4 (s) + 2H2O (l)
เกลือที่เกิดจากกรดและเบสทำปฏิกิริยากัน ไอออนบวกของเกลือจะมาจากเบส
ส่วนไอออนลบของเกลือมาจากกรด
เกลือที่เกิดจากปฏิกิริยาระหว่างกรดกับเบส แบ่งออกได้เป็น
1.1 เกลือที่เกิดจากกรดแก่และเบสแก่ ตัวอย่างเช่น
- NaCl เกิดจากกรด HCl กับเบส NaOH,
HCl (aq) + NaOH (aq)  NaCl (aq) + H2O (l) NaCl (aq) + H2O (l)
- Ca(NO3)2 เกิดจาก HNO3 และ Ca(OH)2
HNO3 (aq) + Ca(OH)2 (aq)  Ca(NO3)2(aq) + H2O (l) Ca(NO3)2(aq) + H2O (l)
1.2 เกลือที่เกิดจากกรดอ่อนกับเบสแก่ เช่น
- NaClO เกิดจาก HClO และ NaOH
HClO (aq) + NaOH (aq)  NaClO (aq) + H2O (l) NaClO (aq) + H2O (l)
- Ba(C2H3O2)2 เกิดจาก
C2H3O2H และ Ba(OH)2
C2H3O2H(aq) + Ba(OH)2(aq)  Ba(C2H3O2)2(aq)
+ H2O (l) Ba(C2H3O2)2(aq)
+ H2O (l)
1.3 เกลือที่เกิดจากกรดแก่กับเบสอ่อน เช่น
- NH4Cl เกิดจาก HCl กับ NH3
HCl (aq) + NH3 (g)  NH4Cl (aq) NH4Cl (aq)
- Al(NO3)3 เกิดจาก HNO3 (aq)
และ Al(OH)3 (aq)
HNO3 (aq) + Al(OH)3 (aq)  Al(NO3)3(aq) + H2O (l) Al(NO3)3(aq) + H2O (l)
1.4 เกลือที่เกิดจากกรดอ่อนและเบสอ่อน เช่น
- NH4CN เกิดจากกรด HCN กับเบส NH3
HCN(aq) + NH3 (g)  NH4CN (aq) NH4CN (aq)
- FeCO3 เกิดจากกรด H2CO3 (aq)
กับเบส Fe(OH)2 (aq)
H2CO3 (aq) + Fe(OH)2 (aq)  FeCO3(aq) + 2H2O (l) FeCO3(aq) + 2H2O (l)
2. เตรียมจากปฏิกิริยาของโลหะกับกรด
โลหะ + กรด  เกลือ + ก๊าซ เกลือ + ก๊าซ
โลหะ + กรด  เกลือ
+ น้ำ + ก๊าซ เกลือ
+ น้ำ + ก๊าซ
เช่น
Mg (s) + 2HCl (aq)  MgCl2 (aq) + H2 (g) MgCl2 (aq) + H2 (g)
Zn(s) + H2SO4 (aq)  ZnSO4 (aq) + H2 (g) ZnSO4 (aq) + H2 (g)
3Cu(s) + 8HNO3 (aq)  3Cu(NO3)2 (aq) + 4H2O (l) + 2NO
(g) 3Cu(NO3)2 (aq) + 4H2O (l) + 2NO
(g)
3. เตรียมจากปฏิกิริยาของโลหะออกไซด์กับกรด
โลหะออกไซด์ + กรด  เกลือ + น้ำ เกลือ + น้ำ
เช่น CaO (s) + H2SO4 (aq)  CaSO4 (s) + H2O (l) CaSO4 (s) + H2O (l)
CuO (s) + H2SO4 (aq)  CuSO4 (s) + H2O (l) CuSO4 (s) + H2O (l)
MgO (s) + 2HCl (aq)  MgCl2 (aq) + H2O (l) MgCl2 (aq) + H2O (l)
4. เตรียมจากปฏิกิริยาของเกลือกับกรด
FeS(s) + 2HCl (aq)  FeCl2 (aq) + H2S (g) FeCl2 (aq) + H2S (g)
Na2CO3 (s) + H2SO4 (aq) Na2SO4 (aq) + H2CO3 (aq) Na2SO4 (aq) + H2CO3 (aq)
NaHCO3 (s) + HCl(aq) NaCl(aq) + H2O (l) + CO2 (g) NaCl(aq) + H2O (l) + CO2 (g)
BaCO3 (s) + 2HCl (aq)  BaCl2 (aq) + H2O (l) + CO2 (g) BaCl2 (aq) + H2O (l) + CO2 (g)
5.เตรียมจากปฏิกิริยาของเกลือกับเกลือ
NaCl (aq) + AgNO3 (aq)  AgCl(s) + NaNO3 (aq) AgCl(s) + NaNO3 (aq)
BaCl2 (aq) + Na2SO4 (aq)  BaSO4 (s) + 2NaCl (aq) BaSO4 (s) + 2NaCl (aq)
ZnCl2 (aq) + Na2S (aq)  ZnS (s) + 2NaCl (aq) ZnS (s) + 2NaCl (aq)
6.โดยการรวมตัวกันโดยตรงของโลหะกับอโลหะ
2Na(s) + Cl2 (g)  2NaCl
(aq) 2NaCl
(aq)
Fe (s) + S (s)  FeS FeS
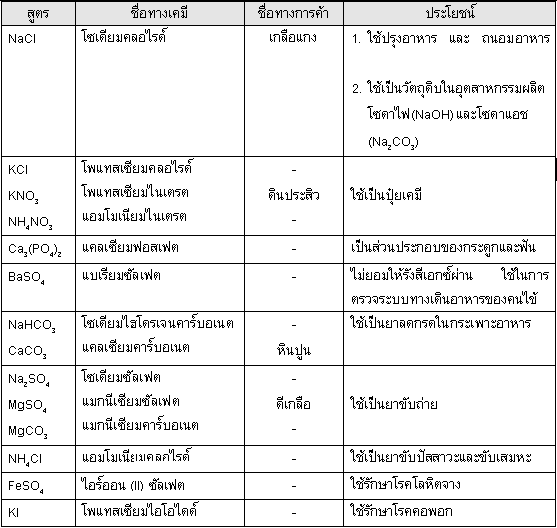
ประโยชน์ของเกลือ
เกลือหลายชนิดมีประโยชน์มากทั้งในชีวิตประจำวัน และในอุตสาหกรรม
ดังแสดงในตาราง
ตัวอย่างที่ 1 จงเขียนสมการ และเรียกชื่อเกลือที่เกิดจากปฏิกิริยาระหว่างสาร
ต่อไปนี้
ก. กรดคาร์บอนิก กับแคลเซียมไฮดรอกไซด์
ข. โซเดียมซัลไฟด์กับกรดซัลฟิวริก
ค. เหล็กกับกรดไฮโดรคลอริก
วิธีทำ
ก. H2CO3 (aq) + Ca(OH)2 (aq)  CaCO3 (s) + 2H2O (l) CaCO3 (s) + 2H2O (l)
แคลเซียมคาร์บอเนต
ข. Na2S (s) + H2SO4 (aq)  Na2SO4 (aq) + H2S (g) Na2SO4 (aq) + H2S (g)
โซเดียมซัลเฟต
หรืออาจเกิดปฏิกิริยาได้อีกแบบหนึ่งดังนี้
Na2S (s) + 2H2SO4 (aq)  2NaHSO4 (aq) + H2S (g) 2NaHSO4 (aq) + H2S (g)
โซเดียมไฮโดรเจนซัลเฟต
ค. Fe(s) + 2HCl(aq) FeCl2 (aq) + H2 (g) FeCl2 (aq) + H2 (g)
ไอร์ออน(II) คลอไรด์
ตัวอย่างที่ 2 จะต้องใช้สาระลายกรดและเบสคู่ใดทำปฏิกิริยากันจึงจะได้เกลือต่อไปนี้
ก. KBr
ข. NH4NO3
ค. BaSO4
ง. NH4HCO3
วิธีทำ
ก. KOH (aq) + HBr (aq)  KBr
(aq) + H2O (l) KBr
(aq) + H2O (l)
ข. NH4OH (aq) + HNO3 (aq)  NH4NO3 (aq) + H2O (l) NH4NO3 (aq) + H2O (l)
ค. H2SO4 (aq) + Ba(OH)2 (aq)  BaSO4 (s) + 2H2O (l) BaSO4 (s) + 2H2O (l)
ง. H2CO3 (aq) + NH4OH (aq)  NH4HCO3 (aq) + H2O (l) NH4HCO3 (aq) + H2O (l)
ตัวอย่างที่ 3 จงเขียนสมการแสดงปฏิกิริยา ระหว่างสารต่อไปนี้พร้อมทั้งเรียกชื่อเกลือที่เกิดขึ้นด้วย
ก. CH3COOH กับ Ca(OH)2
ข. HCl กับ Na2CO3
ค. H2SO4 กับ NaOH
วิธีทำ
ก. 2CH3COOH (aq) + Ca(OH)2 (aq)  (CH3COO)2Ca (aq) + 2H2O (l) (CH3COO)2Ca (aq) + 2H2O (l)
แคลเซียมแอซิเตต
ข. 2HCl (aq) + Na2CO3 (s)  2NaCl (aq) + H2O (l) + CO2 (g) 2NaCl (aq) + H2O (l) + CO2 (g)
โซเดียมคลอไรด์
ค. H2SO4 (aq) + NaOH (aq)  NaHSO4 (aq) + H2O (l) NaHSO4 (aq) + H2O (l)
โซเดียมไฮโดรเจนซัลเฟต
หรือ
H2SO4 (aq) + 2NaOH (aq)  Na2SO4 (aq) + 2H2O (l) Na2SO4 (aq) + 2H2O (l)
โซเดียมซัลเฟต
ปฏิกิริยาไฮโดรลิซิสของเกลือ
(Hydrolysis of Salts)
ไฮโดรลิซิส หมายถึง ปฏิกิริยาระหว่างสาร(เกลือ) กับน้ำ
ไฮโดรลิซิสของเกลือ หมายถึง ปฏิกิริยาระหว่างเกลือกับน้ำ เกลือเป็นอิเล็กทรอไลต์แก่
เมื่อเกลือละลายในน้ำ เกลือจะแตกตัวออกเป็นไอออนบวกและไอออนลบทั้งหมด
ดังนั้น สมบัติของสารละลายของเกลือ จึงขึ้นอยู่กับไอออนบวกและไอออนลบในสารละลายนั้น
ไอออนบางตัวสามารถที่จะทำปฏิกิริยากับน้ำและให้ H+ หรือ
OH- ได้ ปฏิกิริยานี้จึงเรียกว่า ปฏิกิริยาไฮโดรลิซิส
เช่น
- ไอออนลบ เช่น X- เมื่อทำปฏิกิริยากับน้ำ จะเขียนสมการได้ดังนี้
X- (aq) + H2O (l)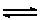 HX (aq) + OH- (aq) HX (aq) + OH- (aq)
จะเห็นว่าจากปฏิกิริยาไฮโดรลิซิสของไอออนลบ X- (aq) ที่เกิดขึ้น
X- (aq) จะรับ H+ จากน้ำแล้วได้ OH- (aq)
ดังนั้นสารละลายที่ได้จึงมีสมบัติเป็นเบส
- สำหรับไอออนบวก เช่น NH4+(aq) เมื่อทำปฏิกิริยากับน้ำ
จะเขียนสมการได้ดังนี้
NH4+ (aq) + H2O(l) 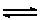 NH3 (g) + H3O+ (aq) NH3 (g) + H3O+ (aq)
จะเห็นว่าจากปฏิกิริยาไฮโดรลิซิสของไอออนบวก NH4+(aq)
ที่เกิดขึ้น NH4+(aq) จะให้โปรตอนกับ H2O
(l) แล้วได้ H3O+ (aq) ดังนั้นสารละลายที่ได้จึงมีสมบัติเป็นกรด
ดังนั้นจึงอาจสรุปได้ว่า ถ้าไอออนลบของเกลือเกิดปฏิกิริยาไฮโดรลิซิสจะทำให้สารละลายแสดงสมบัติความเป็นเบส
และถ้าไอออนบวกของเกลือเกิดปฏิกิริยาไฮโดรลิซิส จะทำให้สารละลายแสดงสมบัติความเป็นกรด
- การพิจารณาว่าไอออนลบใดจะเกิดไฮโดรลิซิสหรือไม่นั้นมีหลักพิจารณาดังนี้
1. ถ้าเป็นไอออนลบของกรดแก่ เช่น Cl-, Br- , I- , NO3- , และ ClO4- จะไม่ทำปฏิกิริยากับน้ำ ดังนั้น จะไม่มีผลต่อค่าความเป็นกรด-เบสของสารละลาย
2. ไอออนลบของกรดอ่อน เช่น CH3COO- , ClO- , CN- , และ CO32- สามารถรับโปรตอนจากน้ำเกิดปฏิกิริยาไฮโดรลิซิสได้สารละลายที่เป็นเบส
เช่น ปฏิกิริยาของ CH3COO- กับน้ำ
CH3COO- (aq) + H2O (l) 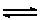 CH3COOH
(aq) + OH- (aq) CH3COOH
(aq) + OH- (aq)
- การพิจารณาว่าไอออนบวกใดจะเกิดปฏิกิริยาไฮโดรลิซิสหรือไม่มีหลักพิจารณาดังนี้
1. ไอออนบวกของโลหะหมู่ IA หรือ IIA (ยกเว้น Be) ได้แก่ Li+ , Na+
, K+ , Mg2+ , Ca2+ และ Ba2+ จะไม่เกิดปฏิกิริยาไฮโดรลิซิส รวมทั้งไอออนบวกของเบสแก่ทั้งหมด
2. แอมโมเนียมไอออนของเกลือแอมโมเนียมจะเกิดปฏิกิริยาไฮโดรลิซิส
และทำให้สารละลายเป็นกรด
1. การไฮโดรลิซิสของเกลือที่เกิดจากกรดแก่และเบสแก่
เกลือประเภทนี้เมื่อละลายในน้ำจะไม่เกิดปฏิกิริยาไฮโดรลิซิสกับน้ำ
ทั้งนี้เพราะ ทั้งไอออนบวกที่มาจากเบสแก่ และไอออนลบที่มจากกรดแก่
ต่างก็ไม่ทำปฏิกิริยากับน้ำ เช่น NaCl เมื่อละลายน้ำได้ Na+ และ Cl- ทั้ง Na+ ซึ่งมาจากเบสแก่ และ Cl- ซึ่งมาจากกรดแก่ HCl จะไม่ทำปฏิกิริยากับน้ำ ไม่มีผลต่อค่า pH ของสารละลาย
สารละลายจึงเป็นกลาง คือมี [H3O+] และ [OH-]
ที่แตกตัวจากน้ำมีปริมาณเท่ากัน pH ของสารละลายเท่ากับ 7
2. การไฮโดรลิซิสของเกลือที่เกิดจากกรดอ่อนกับเบสแก่
เกลือประเภทนี้เมื่อละลายน้ำจะได้ไอออนลบที่มาจากกรดอ่อนที่มีสมบัติเป็นคู่เบสที่แรงพอสมควร
ไอออนลบที่เกิดขึ้นจะเกิดปฏิกิริยาไฮโดรลิซิสกับน้ำได้ OH- ทำให้สารละลายแสดงสมบัติความเป็นเบส
ตัวอย่างเช่น NaClO เมื่อละลายน้ำจะให้ Na+ และ ClO- ดังนี้
NaClO (s)  Na+ (aq) + ClO- (aq) Na+ (aq) + ClO- (aq)
ClO- จะเกิดปฏิกิริยาไฮโดรลิซิส โดยรับโปรตอนจากน้ำได้เป็น
HClO และ OH- ตามสมการ
ClO- (aq) + H2O (l)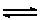 HClO (aq) + OH- (aq) HClO (aq) + OH- (aq)
สำหรับ Na+ (aq) ไอออน ซึ่งมาจากเบสแก่ NaOH ไม่เกิดการไฮโดรลิซิส
ดังนั้นสารละลายที่เกิดจากการละลายของเกลือ NaClO ในน้ำแล้วเกิดการไฮโดรลิซิสของ
ClO- (aq) จะได้ OH- ไอออน จึงแสดงสมบัติเป็นเบส
pH ของสารละลายมีค่ามากกว่า 7
3. การไฮโดรลิซิสของเกลือที่เกิดจากกรดแก่กับเบสอ่อน
เกลือประเภทนี้เมื่อละลายน้ำจะให้ไอออนบวกที่มาจากเบสที่เป็นคู่กรด
ที่มีความแรงพอสมควร ไอออนบวกนี้จะเกิดปฏิกิริยาไฮโดรลิซิสกับน้ำให้
H3O+ ทำให้สารละลายแสดงสมบัติเป็นกรด
ส่วนไอออนลบซึ่งมาจากกรดแก่ ไม่เกิดปฏิกิริยาไฮโดรลิซิส ตัวอย่างเช่น
NH4Cl ซึ่งเกิดจากกรดแก่ HCl กับเบสอ่อน NH3
NH4Cl แตกตัวในน้ำได้ NH4+ และ
Cl- ทั้งหมด
NH4Cl (aq)  NH4+ (aq) + Cl- (aq) NH4+ (aq) + Cl- (aq)
Cl- ไม่เกิดการไฮโดรลิซิส แต่ NH4+ เกิดไฮโดรลิซิส โดย NH4+ จะให้โปรตอนกับ H2O
ได้เป็น NH3(aq) และ H3O+ (aq) ดังสมการ
NH4+ (aq) + H2O (l)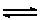 NH3 (aq) + H3O+ (aq) NH3 (aq) + H3O+ (aq)
จะเห็นได้ว่าผลจากการไฮโดรลิซิสของ NH4Cl จะได้ H3O+ ดังนั้นสารละลายของเกลือ NH4Cl จึงแสดงสมบัติเป็นกรด
pH ของสารละลายมีค่าน้อยกว่า 7
4.การไฮโดรลิซิสของเกลือที่เกิดจากกรดอ่อนและเบสอ่อน
เกลือประเภทนี้เมื่อละลายน้ำได้ไอออนบวกและไอออนลบ ซึ่งไอออนทั้งสองนี้
สามารถเกิดปฏิกิริยาไฮโดรลิซิสได้ทั้งคู่ ไอออนบวกของเกลือจะเกิดปฏิกิริยาไฮโดรลิซิสได้
H3O+ ส่วนไอออนลบได้ OH- ดังนั้นความเป็นกรด-เบสของสารละลายจึงขึ้นอยู่กับว่าไอออนบวกหรือไอออนลบเกิดปฏิกิริยาการไฮโดรลิซิสได้ดีกว่ากัน
โดยพิจารณาจากค่าคงที่ของการแตกตัวของคู่เบส (Kb>) (ไอออนลบ) หรือค่าคงที่การแตกตัวของคู่กรด
Ka (ไอออนบวก)
ตัวอย่างเช่น เกลือ NH4CN ที่เกิดจากกรดอ่อน HCN และเบสอ่อน
NH4OH
NH4OH แตกตัวในน้ำให้ NH4+ และ
CN- ดังสมการ
NH4CN (aq)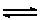 NH4+(aq) + CN-(aq) NH4+(aq) + CN-(aq)
NH4+ และ CN- เกิดปฏิกิริยาการไฮโดรลิซิสดังนี้
NH4+ (aq) + H2O (l)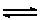 NH3 (aq) + H3O+(aq) ; Ka = 5.6
x 10-10 NH3 (aq) + H3O+(aq) ; Ka = 5.6
x 10-10
CN- (aq) + H2O (l) 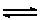 HCN (aq) + OH- (aq) ; Kb = 5.6 x 10-5 HCN (aq) + OH- (aq) ; Kb = 5.6 x 10-5
เนื่องจาก ค่า Kb> Ka ดังนั้นแสดงว่า
CN- เกิดปฏิกิริยาไฮโดรลิซิสให้ OH- ได้ดีกว่า
NH4+ ดังนั้น [OH-] > [NH3]
สารละลายของเกลือ NH4CN จึงแสดงสมบัติเป็นเบส pH มีค่ามากกว่า
7
ตัวอย่างที่ 4 จงเขียนสมการแสดงการละลายน้ำของเกลือโซเดียมแอซิเตต
และให้บอกว่าสารละลายเป็นกรดหรือเบส
วิธีทำ
เกลือโซเดียมแอซิเตต มีสูตรโมเลกุลเป็น CH3COONa เมื่อละลายน้ำจะแตกตัวให้
Na+ และ CH3COO- หมดดังสมการ
CH3COONa (s)  Na+ (aq) + CH3COO- (aq) Na+ (aq) + CH3COO- (aq)
Na+ ไอออน ไม่เกิดปฏิกิริยาไฮโดรลิซิส
CH3COO- เกิดปฏิกิริยาไฮโดรลิซิส โดย CH3COO- รับโปรตอนจากน้ำได้เป็นกรดแอซิติก
CH3COO- (aq) + H2O (l) 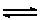 CH3COOH (aq) + OH- (aq) CH3COOH (aq) + OH- (aq)
จะเห็นว่าผลจากการเกิดปฏิกิริยาไฮโดรลิซิสได้ OH- ดังนั้นสารละลายของเกลือโซเดียมแอซิเตตจึงมีสมบัติเป็นเบส
ตัวอย่างที่ 5 F- ไอออนเกิดปฏิกิริยาการไฮโดรลิซิสหรือไม่
ถ้าเกิดสารละลายเป็นกรดหรือเบส
วิธีทำ F- ไอออนเป็นไอออนลบของเกลือที่เกิดจากกรดอ่อน
HF ดังนั้น F- ไอออนเป็นคู่เบสที่มีความแรงเมื่อทำปฏิกิริยากับน้ำจึงสามารถรับโปรตอนจากน้ำได้เป็น
HF และ OH- ดังสมการ
F- (aq) + H2O (l) 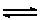 HF(aq) + OH- (aq) HF(aq) + OH- (aq)
จะเห็นได้ว่าผลจากการเกิดปฏิกิริยาไฮโดรลิซิสของ F- จะได้ OH- ดังนั้นสารละลายจึงแสดงสมบัติความเป็นเบส
ตัวอย่างที่ 6 NH4Br เมื่อละลายน้ำจะมีผลต่อค่า pH ของสารละลายอย่างไร
?
วิธีทำ NH4Br ละลายในน้ำจะแตกตัวให้NH4+ และ Br-
NH4Br (s)  NH4+ (aq) + Br- (aq) NH4+ (aq) + Br- (aq)
Br- มาจากกรดแก่ HBr จึงไม่เกิดปฏิกิริยาไฮโดรลิซิส
NH4+ เกิดปฏิกิริยาไฮโดรลิซิสได้ H3O+ ทำให้สารละลายแสดงสมบัติความเป็นกรดโดย ให้ H+ กับน้ำได้
NH3 (aq) และ H3O+ (aq) ดังนี้
NH4+ (aq) + H2O (l)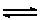 NH3(aq) + H3O+ (aq) NH3(aq) + H3O+ (aq)
5.การไฮโดรลิซิสของไอออนลบของเกลือที่เกิดจากกรดพอลิโปรติก
ไอออนลบของเกลือที่เกิดจากกรดพอลิโปรติก เช่น CO32- , PO43- สามารถเกิดปฏิกิริยาการไฮโดรลิซิสได้หลายขั้น
เนื่องจากสามารถรับ H+ จาก H2O ได้มากกว่า
1 โปรตอน เช่น
ปฏิกิริยาการไฮโดรลิซิสของเกลือ Na2CO3 (s)
เมื่อ เกลือ Na2CO3 (s) ละลายน้ำ จะเกิดการแตกตัวเป็นไอออนได้หมด
คือ
Na2CO3 (s)  Na+ (aq) + CO32-(aq) Na+ (aq) + CO32-(aq)
Na+ ไม่เกิดปฏิกิริยาไฮโดรลิซิส เนื่องจากมาจาก เบสแก่
NaOH
CO32- (aq) เกิดปฏิกิริยาการไฮโดรลิซิสได้
2 ขั้นตอนดังนี้
CO32- (aq) + H2O
(l)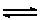 HCO3- (aq) + OH- (aq) HCO3- (aq) + OH- (aq)
และ HCO3- (aq) + H2O (l)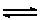 H2CO3 (aq) + OH- (aq) H2CO3 (aq) + OH- (aq)
 แบบฝึกหัด แบบฝึกหัด
หน่วยที่ 4 : เรื่องปฏิกิริยาของกรดและเบส
|