| |
สารละลายอิเล็กทรอไลต์และนอนอิเล็กทรอไลต์
อิเล็กทรอไลต์ (Electrolyte) หมายถึง สารที่เมื่อละลายในน้ำจะนำไฟฟ้าได้ เนื่องจากมีไอออนเคลื่อนที่อยู่ในสารละลาย สารละลายอิเล็กทรอไลต์นี้อาจเป็นสารละลายกรด เบส หรือเกลือก็ได้ ตัวอย่างเช่น สารละลายกรดเกลือ (HCl) สารละลายโซเดียมไฮดรอกไซด์ (NaOH) และสารละลายของเกลือ KNO3 เป็นต้น โดยในสารละลายดังกล่าวประกอบด้วยไอออน H+ , Cl- , OH- , K+ และ NO3- ตามลำดับ
นอนอิเล็กทรอไลต์ (Non-electrolyte) หมายถึง สารที่ไม่สามารถนำไฟฟ้าได้เมื่อละลายน้ำ ทั้งนี้เนื่องจาก สารพวกนอนอิเล็กทรอไลต์ จะไม่สามารถแตกตัวเป็นไอออนได้ เช่น น้ำบริสุทธิ์ น้ำตาล แอลกอฮอล์ เป็นต้น
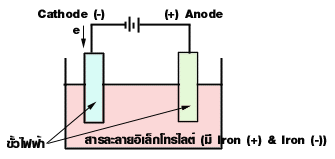
ที่มา : http://www.school.net.th/library/snet5/topic9/electrolite.html
อิเล็กทรอไลต์แก่และอิเล็กทรอไลต์อ่อน
สารละลายอิเล็กทรอไลต์ต่างๆ นำไฟฟ้าได้ไม่เท่ากัน เนื่องจากการแตกตัวเป็นไอออนของอิเล็กทรอไลต์ไม่เท่ากัน อิเล็กทรอไลต์ที่แตกตัวเป็นไอออนได้มากกว่า ก็จะนำไฟฟ้าได้ดีกว่าอิเล็กทรอไลต์ที่แตกตัวเป็นไอออนได้น้อยกว่า อิเล็กทรอไลต์แบ่งออกได้เป็น 2 ประเภท ดังนี้
1. อิเล็กทรอไลต์แก่ (strong electrolyte) หมายถึง สารที่ละลายน้ำแล้วแตกตัวเป็นไอออนได้มาก อาจจะแตกตัวได้ 100% และนำไฟฟ้าได้ดีมาก เช่น กรดแก่ และเบสแก่ และเกลือส่วนใหญ่จะแตกตัวได้ 100% เป็นต้น
2. อิเล็กทรอไลต์อ่อน (weak electrolyte) หมายถึง สารที่ละลายน้ำแล้วแตกตัวได้บางส่วน นำไฟฟ้าได้น้อย
ตารางตัวอย่างของอิเล็กทรอไลต์แก่ และอิเล็กทรอไลต์อ่อนบางชนิด
อิเล็กทรอไลต์แก่ (นำไฟฟ้าได้ดี)
|
อิเล็กทรอไลต์อ่อน (นำไฟฟ้าได้ไม่ดี) |
เกลือที่ละลายน้ำทั้งหมด
H2SO4
HNO3
HCI
HBr
HCIO4
NaOH
KOH
Ca(OH)2
Ba(OH)2 |
CH3COOH
H2CO3
HNO2
H2SO3
H2S
H2C2O4
H3BO3
HCIO
NH4OH
HF |
เราจะรู้ได้อย่างไรว่าสารละลายของเราเป็นสารละลายอิเล็กทรอไลต์หรือไม่?
การทดสอบว่าสารละลายเป็นสารละลายอิเล็กทรอไลต์ หรือไม่ก็ต้องดูการนำไฟฟ้าของสารละลาย เราอาจทดสอบโดยใช้เครื่องมือง่ายๆ ดังนี้
การทดสอบการนำไฟฟ้าของสารละลาย
สารละลายที่นำไฟฟ้า ได้แก่ สารละลายของกรด เบส และเกลือ อุปกรณ์ที่ใช้ในการทดลอง ประกอบด้วยขั้วไฟฟ้า 2 ขั้ว ต่อเข้ากับแหล่งให้พลังงานไฟฟ้า
( ให้ศักย์ไฟฟ้า) หลอดไฟ และสวิตซ์ให้ครบวงจรดังภาพ
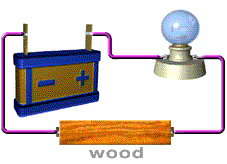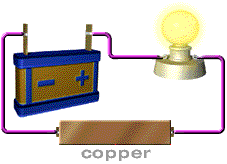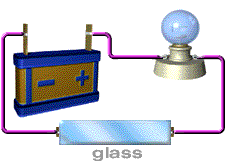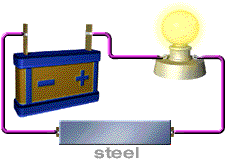
ภาพอุปกรณ์การวัดการนำไฟฟ้าของสารละลายอิเล็กทรอไลต์
ที่มา http://ssga.ru
ตัวอย่างผลการทดลองการทดสอบการนำไฟฟ้า
สารที่ใช้ทดสอบ |
ผลการทดสอบ |
น้ำบริสุทธิ์
น้ำมันที่มีน้ำตาลละลายอยู่
ยูเรีย CO(NH2)2
สารละลายเกลือ NaCl
สารละลายเกลือ K2SO4
สารละลายกรด HCI
สารละลายกรดแอซิติก CH3COOH
สารละลายเบส NaOH
สารละลายเบส NH4OH |
ไม่นำไฟฟ้า (หลอดไฟไม่สว่าง)
ไม่นำไฟฟ้า (หลอดไฟไม่สว่าง)
ไม่นำไฟฟ้า (หลอดไฟไม่สว่าง)
นำไฟฟ้า (หลอดไฟสว่าง)
นำไฟฟ้า (หลอดไฟสว่าง)
นำไฟฟ้า (หลอดไฟสว่าง)
นำไฟฟ้าน้อย (หลอดไฟสว่าง)
นำไฟฟ้า (หลอดไฟสว่าง)
นำไฟฟ้า (หลอดไฟสว่าง) |
ผลที่ได้อธิบายได้ว่า สารละลายที่ไม่มีไอออนอยู่ เช่น น้ำบริสุทธิ์ หรือน้ำตาลที่ละลายอยู่ในน้ำมัน จะมีพันธะแบบโคเวเลนต์ ไม่สามารถแตกตัวเป็นไอออนได้ จึงไม่นำไฟฟ้า แต่ NaCl HCl เมื่ออยู่ในน้ำจะแตกตัวเป็น Na+ , Cl- หรือ H+ , Cl- ซึ่งเป็นไอออนที่เคลื่อนที่ในสารละลายทำให้เกิดการนำไฟฟ้าขึ้นได้
|