|
| |
||
|
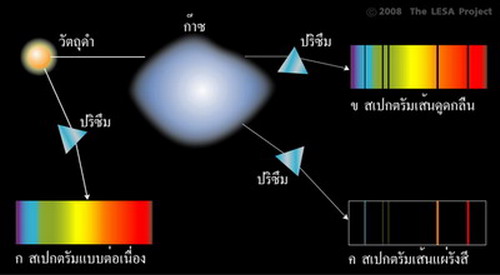
วัตถุดำ (Blackbody) ไม่ได้หมายถึงวัตถุสีดำ แต่เป็นวัตถุในอุดมคติ (Ideal) ซึ่งมีคุณสมบัติในการดูดกลืนรังสีทุกชนิด มันจึงไม่สามารถสะท้อนแสงได้ อย่างไรก็ตามวัตถุดำจะแผ่รังสีออกจากตัวของมันเอง เมื่อรังสีถูกหักเหด้วยแท่งแก้วปริซึมหรือแผ่นเกรตติ้ง ก็จะให้แถบสเปกตรัมยาวต่อเนื่อง วัตถุที่มีคุณสมบัติที่ใกล้เคียงกับวัตถุดำมากที่สุดก็คือ ดาวฤกษ์ เช่น ดวงอาทิตย์ เป็นต้น ปี ค.ศ.1814 โจเซฟ ฟอน ฟรังโฮเฟอร์ นักวิทยาศาสตร์ชาวเยอรมัน ได้ทำการทดลองซ้ำกับเซอร์ไอแซค นิวตัน แต่ใช้แผ่นเกรตติ้งแทนแท่งแก้วปริซึมหักเหแสงอาทิตย์ เขาพบเส้นมืดปรากฏบนแถบสเปกตรัมมากกว่า 600 เส้น ดังภาพที่ 1 (ในปัจจุบันตรวจพบมากกว่า 30,000 เส้น) นักเคมีในยุคต่อมาเรียกเส้นมืดเหล่านี้ว่า เส้นดูดกลืน (Absorption lines) ธาตุแต่ละชนิดทำให้เกิดเส้นดูดกลืนที่แตกต่างกัน
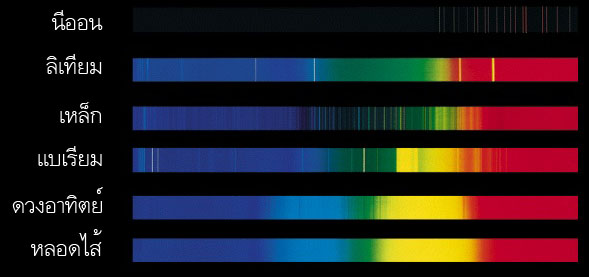
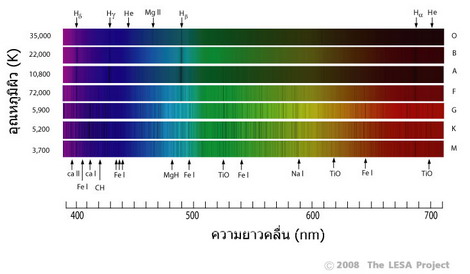
ปี ค.ศ.1859 โรเบิร์ต บุนเซน และ กุสตาฟ เคิร์ชฮอฟ นักเคมีชาวเยอรมัน ได้ทำการทดลองเผาก๊าซร้อน แล้วพบว่า แสงจากก๊าซร้อนทำให้เกิด เส้นสว่างบนแถบสเปกตรัม ก๊าซแต่ละชนิดให้จำนวนและตำแหน่งของเส้นสว่างแตกต่างกัน เราเรียกเส้นสว่างนี้ว่า เส้นแผ่รังสี (Emission lines) ในเวลาต่อมา เคิร์ชฮอฟ ได้ค้นพบความสัมพันธ์ระหว่าง เส้นดูดกลืนและเส้นแผ่รังสี ตามกฏเคอร์เคิร์ชฮอฟ (Kirchhoffs laws) ดังนี้ เส้นสเปกตรัมที่แผ่ออกจากวัตถุแต่ละชนิด มีลักษณะเฉพาะตัวเช่นเดียวกับเส้นลายมือของมนุษย์ ถ้าเราทราบข้อมูลสเปกตรัม เราก็จะสามารถวิเคราะห์ได้ว่า องค์ประกอบของวัตถุต้นกำเนิดมีองค์ประกอบเป็นอะไร วัตถุที่มีคุณสมบัติใกล้เคียงกับวัตถุดำ เช่น ดวงอาทิตย์ และไส้หลอดไฟต่างๆ จะให้สเปกตรัมต่อเนื่อง มีเส้นดูดกลืนสีดำคาดในแนวดิ่ง เนื่องจากมีบรรยากาศห่อหุ้มอยู่ ส่วนก๊าซเรืองแสงเช่น นีออน ให้สเปกตรัมเป็นแถบมืด และมีเส้นแผ่รังสี สว่างคาดในแนวดิ่ง ดังภาพที่ 3 ในการศึกษาองค์ประกอบของดาวฤกษ์ด้วยการวิเคราะห์สเปกตรัม นักดาราศาสตร์แบ่งดาวฤกษ์ออกเป็น 7 ประเภท ตามอุณหภูมิ ได้แก่ ดาวประเภท O, B, A, F, G, K, M โดยมีคำพูดให้ท่องจำได้ง่ายว่า Oh Be A Fine Girl Kiss Me ดาว O มีอุณหภูมิสูงถึง 35,000 K ส่วนดาว M มีอุณหภูมิต่ำเพียง 3,500 K (ภาพที่ 4) เราจะเห็นได้ว่า สเปกตรัมของดาวฤกษ์แต่ละประเภทจะมีเส้นดูดกลืนสีดำ ซึ่งแสดงถึงองค์ประกอบในบรรยากาศที่ห่อหุ้มดาวต่างๆ กัน เส้นดูดกลืนของสเปกตรัม O เกิดจากการดูดกลืนของอะตอมไฮโดรเจนและฮีเลียม ส่วนเส้นดูดกลืนของดาว K เกิดจากการดูดกลืนของธาตุหนักหลายชนิด นอกจากนั้นยังพบเส้นดูดกลืนของโมเลกุลอยู่เป็นจำนวนมาก เนื่องจากอุณหภูมิต่ำพอที่อะตอมสามารถจับตัวกันเป็นโมเลกุล เช่น ไททาเนียมออกไซด์ (TiO) เป็นต้น อย่างไรก็ตามดาว O บางดวงอาจมีธาตุหนักปนอยู่ เนื่องจากเกิดจากการรวมตัวของกลุ่มฝุ่นที่เป็นซาก ซูเปอร์โนวา ซึ่งเกิดจากการระเบิดของดาวฤกษ์รุ่นก่อนๆ
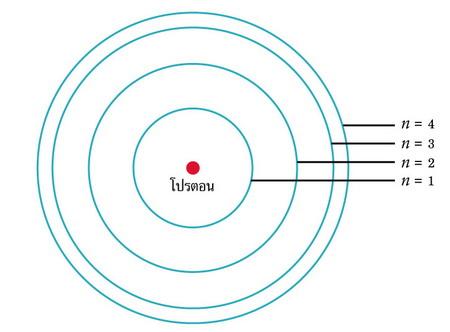
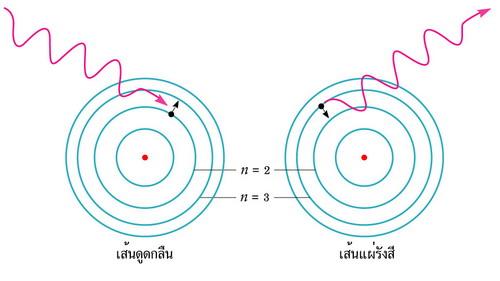
ค.ศ.1910 เออร์เนส รูเธอร์ฟอร์ด นักเคมีฟิสิกส์ชาวนิวซีแลนด์ นำเสนอแบบจำลองโครงสร้างอะตอมว่า นิวเคลียสของอะตอมประกอบด้วย ประจุบวก (โปรตอน) อยู่ตรงกลาง มีประจุลบ (อิเล็กตรอน) โคจรล้อมรอบเป็นชั้นๆ โดยที่มวลส่วนใหญ่ไม่น้อยกว่า 99.98% อยู่ที่นิวเคลียสของอะตอม ปัจจุบันเป็นที่ทราบกันดีว่า นิวเคลียสของอะตอมประกอบด้วยโปรตอนและนิวตอน ค.ศ.1911 นีล บอฮ์ร นักฟิสิกส์ชาวดัทช์ ได้สร้างแบบจำลองอะตอมของไฮโดรเจน เพื่ออธิบายความสัมพันธ์ระหว่างโครงสร้างอะตอมและสเปกตรัมของอะตอม อะตอมของไฮโดรเจนมีโปรตอน 1 อนุภาคอยู่ตรงใจกลาง มีอิเล็กตรอน 1 อนุภาค โคจรล้อมรอบ วงโคจรของอิเล็กตรอนมี 4 ชั้น คือ n = 1, 2, 3 และ 4 ตามลำดับ ดังในภาพที่ 5 โดยทั้งนี้ อิเล็กตรอนสามารถกระโดดข้ามชั้นวงโคจรจากวงหนึ่งไปสู่อีกวงหนึ่งได้ เมื่อมันได้รับหรือสูญเสียพลังงาน เมื่ออะตอมได้รับพลังงานจากภายนอก อิเล็กตรอนจะกระโดดขึ้นสู่วงโคจรชั้นนอก ทำให้เกิดเส้นดูดกลืนในแถบสเปกตรัม ตามกฎข้อที่ 3 ของเคิร์ชฮอฟ แต่เมื่ออะตอมสูญเสียพลังงาน อิเล็กตรอนจะลดลงสู่วงโคจรชั้นใน ทำให้เกิดเส้นแผ่รังสีสว่างบนแถบมืด ตามกฎข้อที่ 2 ของเคิร์ชฮอฟ ภาพที่ 6 ซ้ายมือ แสดงเส้นดูดกลืนของไฮโดรเจน-อัลฟา (H-Alpha) ซึ่งเกิดจากอะตอมได้รับรับพลังงานในช่วงความยาวคลื่น 656.3 นาโนเมตร ทำให้อิเล็กตรอนของไฮโดรเจนในวงโคจร n = 2 ยกตัวขึ้นสู่วงโคจร n = 3 ภาพที่ 6ขวามือ แสดงเส้นแผ่รังสีของไฮโดรเจน-อัลฟา ซึ่งเกิดจากการสูญเสียพลังงานของอะตอม ทำให้อิเล็กตรอนของไฮโดรเจนลดตัวจากวงโคจร n = 3 ลงไปสู่วงโคจร n = 2 ปลดปล่อยพลังงานในช่วงความยาวคลื่น 656.3 นาโนเมตร
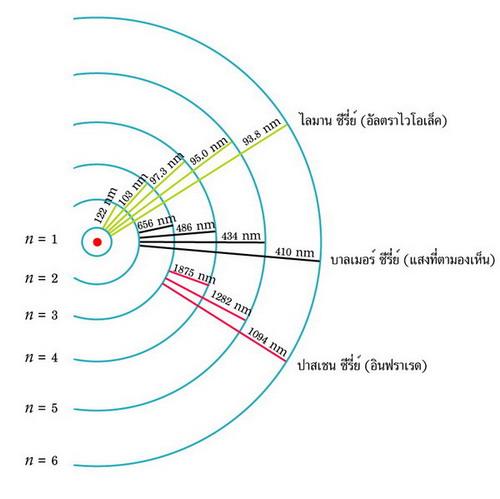
นีล บอฮ์ร อธิบายถึงความสัมพันธ์ระหว่างความยาวคลื่นกับโครงสร้างอะตอมไฮโดรเจน ด้วยสูตร 1/ โดย N = ลำดับวงโคจรชั้นใน เขาใช้สูตรนี้ อธิบายเส้นดูดกลืนต่างๆ บนสเปคตรัมของดวงอาทิตย์ ซึ่งเกิดจากการเปลี่ยนแปลงชั้นวงโคจรของ อิเล็กตรอนของไฮโดรเจน ดังภาพที่ 7 การเลื่อนชั้นวงโคจของอิเล็กตรอนของไฮโดรเจนระหว่างชั้น n = 1 กับชั้น n = 2, 3, 4, 5, 6 ทำให้เกิดเส้นสเปกตรัมที่ความยาวคลื่น 122 nm, 103 nm, 97 nm, 95 nm, 94 nm ตามลำดับ (nm คือ นาโนเมตร หรือ 10-9 เมตร) เรียกว่า ไลมานซีรีส์ อยู่ในช่วงคลื่นอัลตราไวโอเล็ต จึงมีพลังงานสูงมาก การเลื่อนชั้นวงโคจรของอิเล็กตรอนของไฮโดรเจนระหว่างชั้น n = 2 กับชั้น n = 3, 4, 5, 6 ทำให้เกิดเส้นสเปกตรัมที่ความยาวคลื่น 656 nm (H-alpha), 486nm (H-beta), 434nm (H-gamma), 410nm (H-delta) ตามลำดับ เรียกว่า บาลเมอร์ซีรีส์ ซึ่งเป็นแสงในช่วงคลื่นตามองเห็น นักดาราศาสตร์นิยมศึกษาพวยก๊าซบนดวงอาทิตย์ (Prominences) ด้วยแสงไฮโดรเจน-อัลฟา ที่ความยาวคลื่น 656 nm การเลื่อนชั้นวงโคจรของอิเล็กตรอนของไฮโดรเจนระหว่างชั้น n = 3 กับชั้น n = 4, 5, 6 ทำให้เกิดเส้นสเปกตรัมที่ความยาวคลื่น 1875nm, 1282nm, 1094nm ตามลำดับ เรียกว่า ปาสเชนซีรีส์ ในช่วงอินฟราเรด
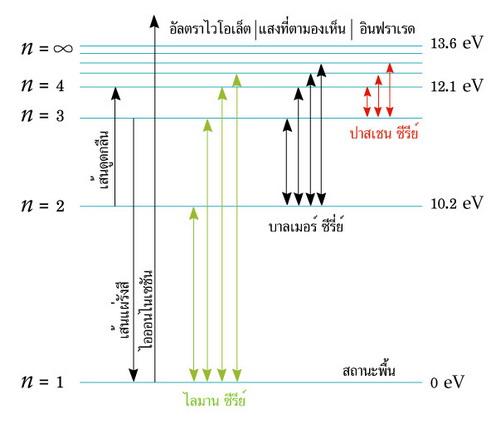
เราสามารถคำนวณระดับพลังงานภายในอะตอมได้โดยใช้สูตร ภาพที่ 9 แสดงให้เห็นกลไกของระดับพลังงานภายในอะตอม เรียกว่า กลไกควอนตัม (Quantum machanics) อิเล็กตรอนมีพลังงานต่ำสุดเมื่ออยู่ในวงโคจรชั้นล่างสุด n = 1 ซึ่งเรียกว่า Ground state วงโคจรชั้นสูงกว่าเราเรียกว่า Excited state อิเล็กตรอนจะกระโดดขึ้นสู่วงโคจรชั้น n = 2 ได้ต่อเมื่อได้รับพลังงานจากโฟตอน Lymann-alpha ซึ่งมีความยาวคลื่น 122 nm ซึ่งมีพลังงาน 10.19 eV ในทำนองกลับกันเมื่ออิเล็กตรอนลดวงโคจรจากชั้น n = 2 ลงสู่ Ground state ก็จะแผ่รังสี Lymann-alpha ซึ่งมีความยาวคลื่น 122 nm ในทำนองเดียวกันเมื่ออิเล็กตรอนยกตัวจาก ground state ไปยังวงโคจรชั้น n = 3 ต้องใช้พลังงาน 12.07 eV ซึ่งได้มากจากโฟตอน Lymann-beta ซึ่งมีความยาวคลื่น 103 nm และเมื่ออิเล็กตรอนลดวงโคจรจากชั้น n = 3 ลงสู่ Ground State มันจะแผ่รังสี Lymann-beta ซึ่งมีความยาวคลื่น 103 nm อย่างไรก็ตามหากอะตอมได้รับพลังงานจากโฟตอนของรังสีอัลตราไวโอเล็ต หรือคลื่นที่สั้นกว่า ซึ่งมีพลังงานสูงมากกว่า 13.6 eV อิเล็กตรอนจะหลุดออกจากอะตอมไปสู่สภาวะ Ionizationation หรือหลุดเป็นประจุ ุ
|
||